当前位置: 首页 > 实验服务 > 合成常见问答

合成常见问答
Q-1: 怎样对合成DNA/RNA制品进行定量? A-1: 由于核酸在260 nm附近有强吸收,因此常根据此性质,用紫外分光光度计测定核酸溶液在260 nm的吸光度值,据此对核酸进行定量,用OD值来表示。1 OD是指:置于光路长度为1 cm的比色皿中的DNA/RNA溶液,如果其在260 nm处的吸光度值为1,则称1 ml该溶液中溶解的DNA/RNA的量为1 OD。1个OD值的合成DNA/RNA的质量约为33 μg。
Q-2: 如何测定并计算OD值? A-2: 将DNA/RNA溶液进行适当稀释,使吸光度测定值与样品浓度的关系在直线范围内,再根据原溶液的总体积与稀释倍数计算该溶液的总OD值。例如,一个200 μl的DNA/RNA溶液,如果对其进行6倍稀释,测定值为1.0时,则该溶液的总OD值为:0.2 ml×6×1.0 OD/ml=1.2 OD 。
Q-3: 合成的DNA应如何保存? A-3:
1. 干燥制品很稳定,-20℃下保存2年没问题。
2. 溶解后的DNA也请保存于-20℃,最好是分份保存,避免反复冻融。
Q-4: 合成DNA溶液在室温下放置了数天,还可以使用吗? A-4: 溶液中的Oligo DNA在常温下放置3~4天应该没问题,但最好不要放置一个星期以上。其寿命与容器、溶剂的灭菌程度有关。
Q-5: 合成的RNA应如何保存? A-5:
1. 干燥制品如能存放于-80℃是最理想的,如不能请于-20℃保存,保存2年没问题。2. 溶液状态的RNA最好保存在-80℃,如无条件,请保存于-20℃。
Q-6: 合成的荧光标记探针应如何保存? A-6:
1. 荧光探针必须避光保存。2. 本公司做过几条探针的保存稳定性试验,干燥品-20℃保存2年未发现降解。作为本公司试剂盒中的组分,-20℃保存2年,探针功能正常。
Q-7: 制品溶解后发现有少许沉淀,会影响实验结果吗? A-7: 所有的制品纯化后都要进行脱盐,脱盐是使用C18柱进行的,偶而会有微量的树脂溢出而进入制品。树脂不影响任何反应结果,请稍许离心后取上清使用。
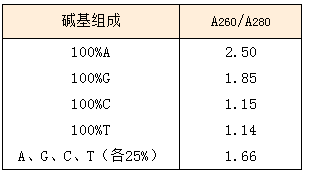
Q-8: 测定了制品的OD值后发现OD260/OD280<1.8,制品质量 (纯度) 合格吗? A-8: 由于核酸在260 nm附近有强吸收,而蛋白质在280 nm附近有强吸收,从生物体内提取核酸时,常用OD260/OD280比值来评价核酸纯度 (比值在1.8~2.0之间),这一判断是基于序列中A、G、C、T所占比例大致相同时的结果。而合成的DNA/RNA则不同,序列很短 (通常在20~30个碱基之间),其中A、G、C、T各种碱基所占比例很不相同,由于各种碱基的摩尔消光系数不同,因此不同碱基构成的合成DNA/RNA制品的OD260/OD280比值也不同,例如当序列中C、T碱基的含量高时,该比值会大大低于1.8。此外,序列中碱基的排列顺序也影响该比值。所以不能根据OD260/OD280比值来评价合成DNA/RNA制品的纯度。
Q-9: 能否根据电泳带的亮度对合成的DNA/RNA制品进行定量?
A-9:
不能。因为EtBr是通过嵌入到核酸的双螺旋间而使其着色的。合成的DNA/RNA分子为单链,只有通过自身回折形成局部发夹环结构或链间形成部分双螺旋结构,才能被EtBr染色。由于不同制品的序列不同,形成双螺旋的能力不同,因此染色能力不尽相同,也就不能根据EtBr染色带的亮度来对合成的DNA/RNA进行定量。
Q-10: 使用3%的Agarose凝胶电泳合成Oligo DNA制品,发现有很多条泳带,为什么?
A-10:
Oligo DNA的电泳一定要使用变性PAGE电泳。Oligo DNA是单链DNA,容易形成复杂的立体结构,因此进行Agarose电泳时,容易出现多条泳带 (更无法用Agarose电泳进行定量了)。
Q-11: 进行PAGE电泳时,长度完全一样的Oligo DNA为什么泳带不在同一位置?
A-11:
1. A、G、C、T的组份不同,电泳速度不同;
2. DNA的立体结构不同,电泳速度不同。 这种情况在Oligo DNA越短时越容易发生,长链Oligo DNA之间差别较小。
Q-12: PCR产物经克隆后测序发现,引物处的碱基有错误,为什么?
A-12:
如果测序后引物处出现了问题,不排除PCR错配的可能,但更主要的原因应在合成引物本身。在引物合成过程中,除了人为将序列输错 (可核对合成报告单),化学合成方法本身不可避免地会产生失败序列,具体分析如下:1. 由于DNA合成是从3′ →5′ 端一个碱基一个碱基地连接上去的,每连接上一个碱基,都需要多步化学反应 (Detritylation、Coupling、Capping、Oxidation),我们称之为一个循环。Coupling是上一个碱基的5′ OH 与下一个碱基的3′ 活性部分发生偶联反应,该反应的效率最高可达99%,即便如此,仍有1%的序列不能连接下一个碱基,这些序列在经过Capping后脱离循环,成为缺碱基的失败序列;
2. Capping是将没有连接上下一个碱基的5′ -OH乙酰化,阻止其进一步延伸。Capping的效率不可能达到100%,没有被Cap的5′ OH会进一步发生反应,造成中间缺碱基的失败序列;
3. Detritylation是将上一个碱基5′ OH上的保护基脱掉,准备连接下一个新碱基,脱保护的效率也很难达到100%,没有脱保护的5′OH会跳过该循环而直接进入下一个循环,造成中间缺碱基的失败序列;
4. 在Coupling步骤中,新碱基 (活性状态) 在没有与上一个碱基发生偶联反应前发生自身连接,造成多碱基的失败序列;
5. 合成时碱基G可能会转化成烯醇式异构体,PCR扩增时被DNA聚合酶识别作A,发生 G到A的转换。上述各种原因产生的失败序列可通过纯化不同程度地得到去除。对40 mer以下的DNA制品,HPLC是最好的纯化方法,其次是PAGE;而对40 mer以上的DNA制品PAGE纯化要优于单纯的HPLC纯化。所以,如您要对PCR产物克隆后测序,一定要选择PAGE纯化或HPLC纯化的引物。
Q-13: PCR产物经克隆后测序发现,引物处的碱基有错误,怎么办?
A-13:
1. 因为引物纯度不可能是100%,因此,挑选克隆时,有可能挑选了杂质引物扩增出的PCR产物的克隆。此时,请重新挑选一个克隆测序,会得到正确的结果。
2. 如果挑选2~3个克隆测序情况还没改观,我们会免费重新合成引物。
Q-14: 进行蛋白表达实验数个月不成功,后经测序发现引物处有错误,怎么办?
A-14:
1. 表达实验之前一定要对DNA序列进行验证。
2. 我们可以免费重新合成引物。
3. 如进行索赔时,按国际行业惯例,索赔范围限于制品价格范围之内。
Q-15: 怎样才能保证Oligo DNA的正确性?
A-15:
1. 合成Oligo DNA时,选用高纯度级制品。
2. 避免使用过长的Oligo DNA,最好选用小于35 mer的合成DNA制品。
3. 进行克隆实验时,每次克隆都须进行测序验证,以保证序列的正确性,然后再进行进一步实验。进行蛋白表达实验时,尤其需要注意。
Q-16: Takara可合成多长的DNA,多长的RNA?
A-16:
Takara合成DNA的长度为2~150个碱基;合成RNA的长度为2~60个碱基。当合成的DNA序列较长时,由于合成及纯化方法的限制,很难保证制品中每个序列都正确无误。此外需要说明的是:如果待合成序列比较特殊 (例如多个“G”连续出现等),合成收率相对较低,我们可能会根据具体情况加收费用;有时我们也可能无法合成订购的序列,此时本公司保留不接受定单的权利。
Q-17: 一般的合成Oligo DNA的5' 和3' 末端有磷酸基团吗?
A-17:
没有,5' 和3' 末端均为-OH基。如需要加磷酸基团,订货时请特别注明,此时需收取磷酸化 (PO4修饰) 的费用。
Q-18: 平端的PCR产物难以克隆,为什么?
A-18:
由于一般的PCR用引物的5′ 末端都没有磷酸基团,因此,扩增后的PCR产物的5′ 末端也没有磷酸基团。当克隆于去磷酸化的末端平滑载体时,无法克隆进去;而当克隆于非去磷酸化的末端平滑载体时,背景会极高。此时请对PCR产物的5′ 端进行磷酸 (PO4修饰) 化处理。
Q-19: 合成的引物进行PCR反应时无目的带,怎么办?
A-19:
PCR反应失败的原因很多,可以从以下几个方面考虑。
1. 引物和模板是否配对,同源性有多大?
2. 引物本身是否有立体结构,或者二条引物之间是否形成高次结构?
3. PCR反应用试剂是否能正常工作?
4. PCR仪是否工作正常?
5. PCR反应条件是否合适?
如果一切正常,还无法解决问题时,我们可以免费重新合成引物。如果重新合成的引物也无法解决问题时,请把引物和模板寄送给我们公司,我们可以帮助摸索PCR反应条件。
Q-20: 进行反义核酸实验时,是否要对DNA链全部进行S代修饰,除了S代外,还有什么办法可增加核酸在生物体内的稳定性?
A-20:
DNA经S代修饰后比较稳定,在细胞中不会被核酸酶降解。如果整条链全部S代,的确能增加DNA的稳定性,但会降低其TM值,也即降低该反义DNA与靶序列的结合效率。因此,科研人员一般采用将DNA片段两端插入数个(通常3个)S代磷酯键(Phosphorothioated Bonds),这样既能增加DNA的稳定性,又能增加反义DNA与靶序列的结合能力。不过如果要将反义DNA注入到活的动物体内,为增强稳定性,还是将整条链S代效果更好。
2' O-Me RNA也阻抗核酸酶降解,可与S代DNA构成嵌合的反义核酸,这样既能增强反义核酸的稳定性,又能增加其与靶序列的亲和性 (2' -OMe-RNA与RNA的亲和力要比DNA与RNA的亲和力大很多)。
此外,5-Me-dC由于能增强DNA双螺旋的稳定性,有时也被掺入到S代的反义核酸中。
购买记录 0 件
用户名 购买数量 购买时间 订单状态 总计 0 个记录,共 1 页。









 Global - English
Global - English
 China - 中文
China - 中文
 Brasil - Português
Brasil - Português
 France - Français
France - Français
 Germany - Deutsch
Germany - Deutsch
 Hungary - Magyarország
Hungary - Magyarország
 Italy - Italiano
Italy - Italiano
 Japan -日本语
Japan -日本语
 Russia - Россия
Russia - Россия
 United States - English
United States - English

